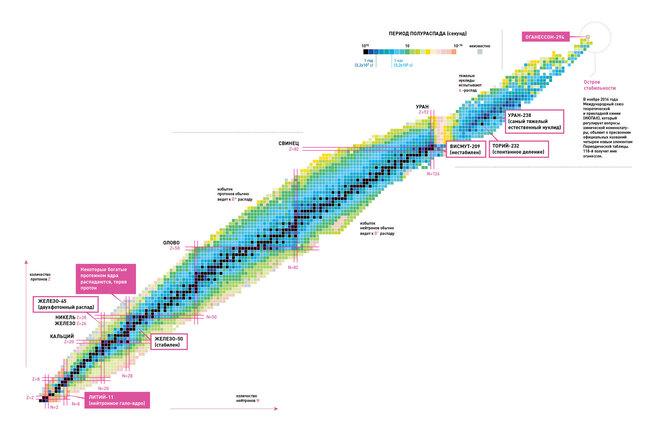
Elementide perioodilisuse tabeli piirid. Kus on stabiilsuse õnnelik saar?
Kas elementide perioodilisuse tabelil on "ülemine" piir – seega on üliraske elemendi teoreetiline aatomarv, milleni teadaolevas füüsilises maailmas oleks võimatu jõuda? Vene füüsik Juri Oganesjan, kelle järgi on nimetatud element 118, usub, et selline piir peab olema.
Venemaal Dubnas asuva tuumauuringute ühendinstituudi (JINR) Flerovi labori juhataja Oganesjani sõnul on sellise piiri olemasolu relativistlike mõjude tagajärg. Aatomarvu kasvades suureneb tuuma positiivne laeng ning see omakorda suurendab elektronide kiirust ümber tuuma, lähenedes valguse kiiruse piirile, selgitab füüsik ajakirja aprillinumbris ilmunud intervjuus. . Uus Teadlane. „Näiteks elemendi 112 tuumale lähimad elektronid liiguvad 7/10 valguse kiirusega. Kui väliselektronid läheneksid valguse kiirusele, muudaks see aatomi omadusi, rikkudes perioodilisustabeli põhimõtteid,” räägib ta.
Uute üliraskete elementide loomine füüsikalaborites on tüütu ülesanne. Teadlased peavad ülima täpsusega tasakaalustama elementaarosakeste tõmbe- ja tõukejõude. Vaja on "maagilist" prootonite ja neutronite arvu, mis "kleepuvad kokku" soovitud aatomnumbriga tuumas. Protsess ise kiirendab osakesi kümnendikuni valguse kiirusest. Vajaliku arvu üliraske aatomituuma tekkimiseks on väike, kuid mitte null võimalus. Siis on füüsikute ülesanne see võimalikult kiiresti maha jahutada ja enne lagunemist detektorisse “püüda”. Selleks on aga vaja hankida vastavad "toormaterjalid" – haruldased ülikallid elementide isotoobid koos vajalike neutroniressurssidega.
Põhimõtteliselt, mida raskem on transaktiniidirühma element, seda lühem on selle eluiga. Aatomnumbriga 112 elemendi poolväärtusaeg on 29 sekundit, 116 - 60 millisekundit, 118 - 0,9 millisekundit. Arvatakse, et teadus jõuab füüsiliselt võimaliku mateeria piiridesse.
Oganesjan aga ei nõustu. Ta esitab vaatenurga, et ta on üliraskete elementide maailmas. "Stabiilsuse saar". "Uute elementide lagunemisaeg on äärmiselt lühike, kuid kui lisada nende tuumadele neutroneid, pikeneb nende eluiga," märgib ta. "Kaheksa neutroni lisamine elementidele numbritega 110, 111, 112 ja isegi 113 pikendab nende eluiga 100 XNUMX aasta võrra. üks kord".
Nimetatud elemendi Oganesjani järgi Oganesson kuulub transaktiniidide rühma ja selle aatomnumber on 118. Selle sünteesis esmakordselt 2002. aastal rühm Venemaa ja Ameerika teadlasi Dubnas asuvast Tuumauuringute Ühisinstituudist. 2015. aasta detsembris tunnistas see üheks neljast uuest elemendist IUPAC/IUPAP ühistöörühma poolt (Rahvusvahelise Puhta ja Rakenduskeemia Liidu ning Rahvusvahelise Puhta ja Rakendusfüüsika Liidu loodud rühm). Ametlik nimepanek toimus 28. Oganesson ma kõrgeim aatomnumber i suurim aatommass kõigi tuntud elementide hulgas. Aastatel 2002–2005 avastati ainult neli isotoobi 294 aatomit.
See element kuulub perioodilisuse tabeli 18. rühma, s.o. väärisgaasid (olles selle esimene kunstlik esindaja), võib see erinevalt kõigist teistest väärisgaasidest näidata märkimisväärset reaktsioonivõimet. Varem arvati, et oganesson on standardtingimustes gaas, kuid praegused ennustused viitavad nendes tingimustes pidevale agregatsiooni olekule, mis on tingitud relativistlikest mõjudest, mida Oganessian mainis varem viidatud intervjuus. Perioodilises tabelis on see p-plokis, olles seitsmenda perioodi viimane juur.
Nii vene kui ka Ameerika teadlased on sellele ajalooliselt pakkunud erinevaid nimesid. Lõpuks otsustas IUPAC siiski austada Hovhannisjani mälestust, tunnustades tema suurt panust perioodilisuse tabeli raskeimate elementide avastamisel. See element on üks kahest (mereääre kõrval), mis on saanud nime elava inimese järgi.

